Vinnige feite

- Droë lug bevat slegs 0,0018% neon.
- Neon is as ’n verkoelingsmiddel wat 40 keer meer doeltreffend as vloeibare helium is, en drie keer beter as vloeibare waterstof. As dit op jou vel beland, kan dit onmiddellike vriesbrand veroorsaak!
- Neon se lig kan selfs in mistige toestande gesien word, en daarom word neonligte veral by lughawens en in koue omgewings gebruik.
- Hoewel neon duur en seldsaam is, is daar ’n redelike hoeveelheid in die gemiddelde huis beskikbaar. As jy byvoorbeeld al die neon uit ’n huis in Amerika onttrek, sal jy 10 liter se neon hê.
- Neon is lig, en daarom sal ’n ballon wat daarmee gevul is, styg, maar wel baie stadiger as een wat met helium gevul is. 10
- Daar is wetenskaplikes wat glo dat neon wel in staat is om ’n verbinding met fluoor te vorm omdat fluoor die reaktiefste element op die periodieke tabel is. Eksperimentering is egter nog nodig.
- Georges Claude (1870-1960) was ’n Franse ingenieur en chemikus. Dié Fransman was die uitvinder van die neonlig. 11
- Neon word onttrek deur dit in aanraking met geaktiveerde steenkool te bring. Die neon en waterstof word dan geabsorbeer, maar die waterstof moet dan verwyder word. Dit word gedoen deur genoeg suurstof daarby te voeg om dit na water te verander. As dit verkoel word, sal die water kondenseer, en die neon sal oorbly.
- Die ander edelgasse in groep 18 is Helium (He), Argon (Ar), Kripton (Kr), Xeon (Xe) en Radon (Rn).
- Die edelgasse gee nie elektrone af nie, hulle neem dit ook nie op nie en sal dit ook nie met ander atome deel nie. 6
- Edelgasse kan nie in water oplos nie en is die minste reaktiewe elemente in die periodieke tabel.
As ’n mens die woord “neon” hoor, sien jy sommer onmiddellik ’n prentjie van helder kleure en flitsende ligte. Die chemiese element neon is ’n gas wat gloei as ’n elektriese stroom daardeur beweeg. Die atome waaruit die gaspartikels bestaan, word opgewek tot hoër energievlakke, en wanneer die elektrone op en af beweeg na ’n laer energievlak, word lig uitgestraal waarvan die golflengte (kleur) ooreenstem met die eienskappe van die spesifieke gas. 1 Neon word daarom dikwels in flitsende reklameborde (advertensieborde) en in buisligte vir beligting gebruik. Dink maar net aan die foto’s wat jy al van die stad Las Vegas gesien het, daar is derduisende neonreklameborde!

Wetenskaplikes gebruik ’n simbool vir elke element op die periodieke tabel, en die simbool vir Neon is “Ne”. Die gas vorm deel van groep 18 (edelgasse) op die periodieke tabel. Edelgasse is gasse wat nie met ander elemente verbindings vorm nie. ’n Verbinding in chemie is die samevoeging van ongelyksoortige atome tot molekules. Helium (He) en argon (Ar) is ook edelgasse, en die gasse sweef so by hulself rond en maak nie maats met ander gasse nie. 2
Neon is onreaktief, wat beteken dit reageer nie op ander elemente nie. Ons praat van neon as ’n inerte element, en dit het dus min of geen chemiese werking nie.
Nog iets wat jy van neon moet weet, is dat dit geen smaak, kleur of reuk het nie. Dit kan ook nie brand nie, en dit is ligter as lug.
Neon word vloeibaar teen −246.048 °C en vries teen ’n temperatuur van 2½°C en laer.
Die woord neon is van die Griekse woord neos (‘nuut’) afgelei. 3

Wanneer en deur wie is dit ontdek?
Ons weet van neon as gevolg van twee slim Britse chemici wat die gas in 1898 ontdek het. Dit was sir William Ramsay en Morris W. Travers. Hulle het die element in vloeibare lug gevind en gesien dat daar gasse is wat ontsnap het. Die gasse is as suurstof, stikstof, argon en kripton geïdentifiseer. Een gas het agtergebly en het ’n helderrooi lig vrygestel toe elektrisiteit daardeur gelei is. Hulle het besef dat hulle met ’n splinternuwe element te make het, en dit was Ramsay se seun wat die naam “neon” daarvoor voorgestel het. 4

Wetenskaplikes het sommer vinnig geleer hoe om neon uit die lug te kry, sodat dit gebruik kon word. Baanbrekerswerk is gedoen met die ontwikkeling van neonligte en teen die 1920’s was daar al orals neontekens en het dit al hoe gewilder geword.
Neon is egter slegs een van verskeie gasse wat gebruik word om reklameborde te maak. Neon gloei met ’n helderrooi-oranje kleur, helium met ’n pienk kleur, en mengsels van gasse soos neon en argon gloei met ’n blou kleur.

Waar kry ons dit?
Neon is ’n baie seldsame element en kom in die aarde se atmosfeer sowel as in rotse in die aarde se kors voor. Dit is ook al in diamante en vulkane se kraterpype gevind.
Dis baie duur om te vervaardig en kos ongeveer 55 keer meer as vloeibare helium om te produseer. 5
Hoewel neon seldsaam op aarde is, is dit nie seldsaam in die heelal nie en is ’n algemene element in sterre. Dit maak dit die vyfde volopste element in die heelal. Neon word tydens die alfaproses van sterre gemaak – dit is die stadium wanneer helium en suurstof saamsmelt.

Waarvoor word dit gebruik?
Die grootste gebruik van neon is om die borde vir advertensiedoeleindes te maak, maar aangesien neon met ’n helderrooi-oranje kleur gloei, is dit slegs daardie gedeeltes wat suiwer neon is. Die ander bestaan uit verskillende gasse wat verskillende kleure tot gevolg het.
Dit het ook die volgende gebruike:
- Neon word ook in fluoressente lampe gebruik. Fluoressensie is wanneer stowwe stralingsenergie absorbeer of onder bestraling verkeer, en dit straal lig van ’n ander golflengte of kleur as die invallende lig uit.
- Dit word ook in laboratoriums as kriogeniese verkoelingsmiddels gebruik. As iets kriogenies is, kom dit by of in baie lae temperature voor, of het dit baie lae temperature tot gevolg. In hierdie geval word neon in laboratoriums gebruik om biologiese monsters te bewaar en lyke te preserveer.
- Dit kom ook voor in TV’s se plasmaskerms.
- Neon word saam met helium in lasers gebruik. Lasers word vir verskeie doeleindes, soos in wetenskaplike eksperimente of tydens laserchirurgie, gebruik.
- Neon kan ook, soos helium, in diepseeduikers se suurstoftenks gebruik word, maar dit is baie duur, en word daarom weinig gebruik.
- Aangesien neon, soos ander edelgasse, ’n hoë elektriese spanning benodig om elektrisiteit te gelei, werk dit goed in weerligafleiers.
- Dit word ook in spanningsmeters, wat elektriese spanning meet, en golfmeterbuise, wat die afstand tussen golwe meet, gebruik.

Basiese eienskappe van neon
- Atoomgetal (getal protone in die kern): 10
- Simbool op die periodieke tabel: Ne
- Relatiewe atoommassa (Ar): 20,180
- Fase van materie teen kamertemperatuur: Gas

’n Nota oor atoommassa
’n Massaspektrometer kan gebruik word om atoommassa akkuraat te bereken. Wetenskaplikes het ’n standaardmassa van 12 ame (atoommassa-eenheid) aan die koolstofatoom (koolstof-12) toegeken. Die massa van koolstof-12 is 1,99 x 10-26 kg, en ander atome se massa kan relatief tot hierdie atoommassakonstante bepaal word.
Vandag praat wetenskaplikes van die relatiewe atoommassa (Ar). Hierdie waarde het geen eenheid nie, want dit is slegs ’n syfer wat aandui hoeveel maal groter een atoom van die spesifieke element is as een twaalfde van die massa van ’n koolstof-12-atoom. 6

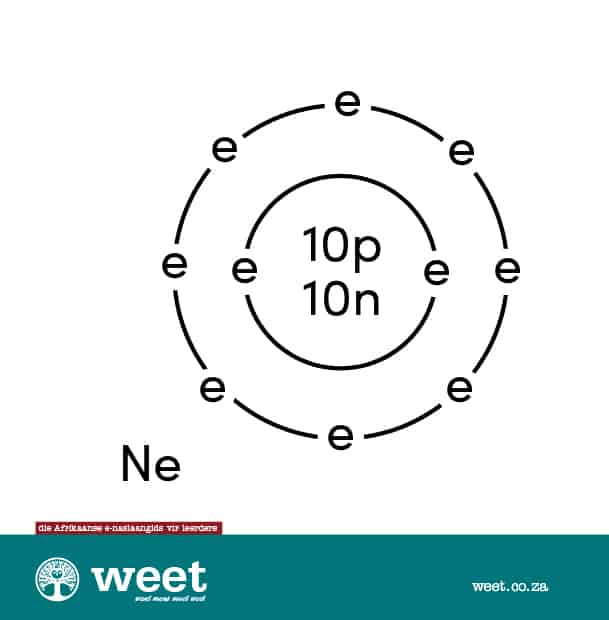
Bohr-model
Die Deense wetenskaplike Niels Bohr (1885-1962) het ’n atoommodel voorgestel. Hierdie model word soms die planetêre atoommodel genoem. Die elektrone beweeg in hul spesifieke energievlakke al óm die kern. Deur die aantal energievlakke en elektrone te tel, kan die atoom maklik uitgeken word. 6
’n Atoom is die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. Atome bestaan weer uit kleiner deeltjies wat subatomiese deeltjies genoem word. Daar is drie soorte subatomiese deeltjies, naamlik elektrone, protone en neutrone. 7 Die neonatoom het ’n atoomgetal van 10. Dit beteken dat die atoom 10 protone het. Atome het ’n neutrale lading, en daarom is daar ook 10 elektrone wat óm die kern beweeg. Die buitenste energievlak het agt elektrone. 8 Dit het ook 10 neutrone wat saam met die protone in die kern voorkom.
Neon se molekules bestaan uit enkelatome. Neon was die eerste element wat gevind is, wat uit meer as een stabiele isotoop bestaan het. ’n Isotoop is enigeen van twee of meer vorme van ’n element wat dieselfde atoomgetal en eenderse chemiese eienskappe het, maar waarvan die atoomgewig en radioaktiewe gedrag verskil. 9
Woordbank
| atome | Dis die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. |
| atoomgetal | Die getal protone in die kern van die atoom |
| atoommassa | Word ook ‘massagetal’ genoem. Dit is die totale aantal protone en neutrone in die kern van die atoom. |
| chemici | ’n Vakkundige in die gebied van chemie. |
| elektrone | Baie klein, negatief gelaaide deeltjies (partikels) wat in die energievlakke van ’n atoom rondbeweeg. Elektrone maak die vorming van chemiese verbindings moontlik. 12 |
| edelgasse | Enigeen van ’n aantal gasse wat in groep 18 voorkom en nie verbindings met ander elemente vorm nie. |
| element | Dit is ’n stof wat saamgestel is uit atome wat dieselfde atoomgetal het. |
| fluoressensie | Wanneer stowwe stralingsenergie absorbeer of onder bestraling verkeer, straal dit lig van ’n ander golflengte of kleur as die invallende lig uit. |
| inerte | Min of geen chemiese werking. |
| isotoop | Enigeen van twee of meer vorme van ’n element wat dieselfde atoomgetal (protone) en eenderse chemiese eienskappe het, maar waarvan die atoommassa en radioaktiewe gedrag verskil. Die aantal protone en elektrone is dus dieselfde, maar die aantal neutrone verskil. |
| kondenseer | Wanneer materie van die gastoestand na die vloeistoftoetstand verander. |
| molekules | Die kleinste deeltjie van ’n stof wat die chemiese en fisiese eienskappe van die stof behou en wat bestaan uit twee of meer atome wat deur chemiese bindings aanmekaar gehou word. |
| neutrone | Neutrale deeltjies (partikels) wat geen elektriese lading het nie en saam met protone in die kern van die atoom voorkom. ’n Neutron en proton het dieselfde gewig. 10 |
| periodieke tabel | Dit is die tabel van die elemente, gerangskik volgens toenemende atoomgetal, sodat elemente met soortgelyke eienskappe in dieselfde vertikale kolom voorkom. |
| protone | Positief gelaaide deeltjies (partikels) wat in die kern van ’n atoom voorkom en die elektrone in posisie hou. Atome het ewe veel protone as elektrone en het dus ’n neutrale lading. 10 |
| verbinding | Dit is die samevoeging van ongelyksoortige atome tot molekules. |
Lees hierdie artikels om meer oor neon te leer
Kyk na hierdie video’s om meer te leer oor neon
Nog inligting oor neon
Wat laat neonborde gloei?

