Vinnige feite

- Kalium is die sewende algemeenste element in die aarde se kors.
- Plantselle is ryk aan kalium wat hulle uit die grond kry. Landbougrond het genoeg kalium nodig, en nadat daar geoes word, moet die kaliumryke kunsmis by die grond gevoeg word.
- Ongeveer 35 miljoen ton kalium word jaarliks gemyn.
- ’n Mengsel van kalium en magnesium word gevind in neerslae wat deur die verdamping van mere gevorm word. Die kaliumsoute kan maklik daar onttrek word. Kaliumsoute word ook in die oseaan gevind, maar in kleiner hoeveelhede as natrium.
- Kalium beslaan ongeveer 2,1% van die aardkors.
- Die gemiddelde mens neem ongeveer 7 g kalium per dag in en berg ongeveer 140 g in die liggaamselle. ’n Gesonde dieet behoort genoeg kalium te bevat.
- Kalium het so ’n lae smeltpunt dat tot ’n kers dit kan laat smelt.
- Dit is glad nie ’n baie digte element nie en is so lig dat dit op water kan dryf.
- ’n Klein hoeveelheid kalium proe soet, terwyl ’n hoër konsentrasie bitter of sout kan proe.
- Sjokolade bevat ook kalium!
’n Vuurwerkvertoning is gewoonlik ’n ontploffing van ’n klomp kleure, maar as jy al spesifiek een met pers gesien het, het jy die element kalium in aksie gesien. Eintlik het jy omtrent elke dag van jou lewe daarmee te make, want kalium is ʼn algemene element wat in ’n groot aantal huishoudelike produkte – soos skottelgoedwasmiddel, sodawater en kunsmis – gebruik word. Dit is boonop belangrik vir die menslike liggaam. 1
Kalium is die vierde element in die eerste groep van die periodieke tabel. Dis een van die alkalimetale. Die alkalimetale reageer hewig met water. Dié hewige reaksies produseer suuraanvallende verbindings wat alkali’s genoem word – vandaar die naam “alkalimetale”. Geeneen van die alkalimetale word in ’n suiwer vorm in die natuur aangetref nie, juis omdat dit so reaktief is.

Kalium is chemies soortgelyk aan natrium. Natrium is ook ’n alkalimetaal, en lê net bo kalium op die periodieke tabel. Kalium se simbool is “K” op die periodieke tabel. Die Engelse woord vir kalium is potassium, en dit is afgelei van die woord potas. Potas is ʼn mengsel van stowwe wat uit die as van verbrande plante wat in water geweek word, gemaak word. Dit word ook “onsuiwer kaliumkarbonaat” of “natuurlike kaliumkarbonaat” genoem. Die Afrikaanse woord “kalium” kom van die Latynse woord kalium, wat ‘as’ beteken. 2
Dit is vreemd om aan ’n metaal as sag te dink, maar kalium is ’n sagte, silwer metaal. Dit is so sag dat ’n mens dit met ’n mes kan sny. Dit is ook hoogs reaktief en meng baie vinnig met ander elemente. Dit reageer maklik met suurstof in die lug, produseer ’n lilapers vlam en vorm ’n oksiedverbinding. Dit reageer ook hewig op water en die hitte wat só geproduseer word, is so erg dat dit in vlamme kan uitbars. Omdat kalium so reaktief is, moet dit gewoonlik in mineraalolie geberg word. 3
Wanneer en deur wie is dit ontdek?
Kalium is in 1807 deur die Engelse chemikus sir Humphry Davy ontdek. Davy het graag met elemente geëksperimenteer en is bekend daarvoor dat hy ’n paar elemente ontdek het. Hy het kalium deur die elektrolise van potas geïsoleer. Elektrolise is die proses waartydens ’n verbinding na eenvoudiger stowwe opgebreek word met die gebruik van ’n elektriese stroom. 4

Waar kom dit voor?
Kalium kom in alle selle in plante en diere voor. Ons liggaam het dit nodig sodat ons spiere en senuwees behoorlik kan werk. Goeie bronne van kalium is boontjies, groen groentes, aartappels, avokado’s, patats en piesangs. Kalium word nooit op sy eie in die natuur gevind nie, maar dit is teenwoordig in minerale soos afwilliet (Engels: afwillite) en silviet (Engels: sylvite). 5 Kaliumhidroksied (bytpotas) is ook ’n belangrike bron van kalium en word hoofsaaklik in Duitsland, Nieu-Mexiko, Kalifornië en Utah gevind.
Waarvoor word dit gebruik?
- Kaliumchloried word gebruik om ander kaliumverbindings mee te maak.
- Kaliumchloried word ook in kunsmis gebruik.

- Kalium word ook gebruik om die smaak van kos en drinkgoed, soos sodawater, lekkerder te maak.
- Kalium word ook by dierevoeding gevoeg.
- Dit is ’n belangrike bestanddeel in drupvloeistof. Dit is wat mense in die hospitaal kry as daar ’n sakkie op ’n staander langs hulle hang. Kaliumchloried en natriumchloried word op hierdie manier binneaars toegedien om pasiënte te rehidreer.
- Kaliumnitraat is ’n verbinding van kalium, suurstof en stikstof. Dit word gebruik om buskruit te maak, selfone se glasskerms te versterk, en dit word ook in kunsmis, vuurwerke en ploftoestelle gebruik.

- Kaliumchloraat is ’n bron van suurstof en word ook in vuurwerke, vuurhoutjies en ploftoestelle gebruik.
- Kaliumverbindings word ook as ’n preserveermiddel in kos gebruik.
- Die elektrolise van kaliumchloried lewer kaliumhidroksied op, en dit is ’n middel wat in seep en waspoeier aangetref word.
- Kalium word ook gebruik om kaliumsout te maak. Kaliumsout bevat kaliumchloried wat help om bloeddruk te verlaag, en dit is ook ’n gesonder alternatief vir natriumchloried, oftewel tafelsout.
- Asemhalingstoestelle bevat kaliumsuperoksied. Wanneer koolstofdioksied uitgeasem word, vind daar ’n chemiese reaksie plaas met kaliumsuperoksied wat suurstof vrystel.

- Kaliumsianied is ’n gif wat in sekere insekweerders gebruik word om insekte te verdryf. Dit word ook gebruik om goud en silwer uit erts te onttrek.
- Kaliumkarbonaat word gebruik in die vervaardiging van glas.
- Kalium vorm ’n allooi met natrium, en dit word in sekere tipes kernkragreaktors gebruik as ’n medium om hitte oor te dra.

Basiese eienskappe van kalium
Atoomgetal (getal protone in die kern): 19
Simbool op die periodieke tabel: K
Relatiewe atoommassa (Ar): 39,0983
Fase van materie teen kamertemperatuur: Vaste stof
Kookpunt: 759 °C
Smeltpunt: 63,38 °C 2

’n Nota oor atoommassa
’n Massaspektrometer kan gebruik word om atoommassa akkuraat te bereken. Wetenskaplikes het ’n standaardmassa van 12 ame (atoommassa-eenheid) aan die koolstofatoom (koolstof-12) toegeken. Die massa van koolstof-12 is 1,99 x 10-26 kg, en ander atome se massa kan relatief tot hierdie atoommassakonstante bepaal word.
Vandag praat wetenskaplikes van die relatiewe atoommassa (Ar). Hierdie waarde het geen eenheid nie, want dit is slegs ’n syfer wat aandui hoeveel maal groter een atoom van die spesifieke element is as een twaalfde van die massa van ’n koolstof-12-atoom. 6
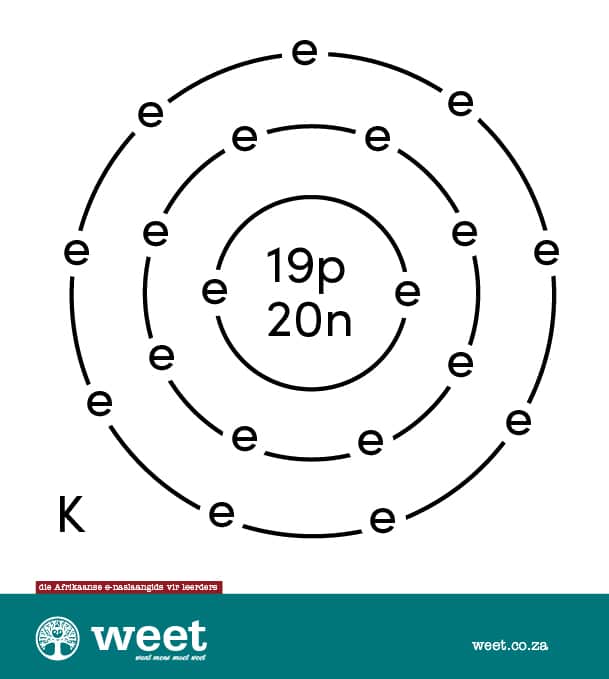
Bohr-model
Die Deense wetenskaplike Niels Bohr (1885-1962) het ’n atoommodel voorgestel. Hierdie model word soms die planetêre atoommodel genoem. Die elektrone beweeg in hul spesifieke energievlakke al óm die kern. Deur die aantal energievlakke en elektrone te tel, kan die atoom maklik uitgeken word. 7
’n Atoom is die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. Atome bestaan weer uit kleiner deeltjies wat subatomiese deeltjies genoem word. Daar is drie soorte subatomiese deeltjies, naamlik elektrone, protone en neutrone. Die kaliumatoom het ’n atoomgetal van 19. Dit beteken dat die atoom 19 protone het. Atome het ’n neutrale lading, en daarom is daar ook 19 elektrone wat óm die kern beweeg. Dit het ook 20 neutrone wat saam met die protone in die kern voorkom. Daar is drie isotope wat natuurlik op die aarde voorkom, hoewel minstens 29 isotope al geïdentifiseer is. 2

Woordbank
| alkali | ’n Verbinding wat waterstofione uit watermolekules opneem as dit in water opgelos word. |
| alkalimetale | Enigeen van die metale in die eerste kolom van die periodieke tabel. Hierdie metale kan met ’n mes gesny word en het ’n blink voorkoms wat vinnig verdof wanneer dit in aanraking met suurstof kom. Hulle is ook baie reaktief, veral in water. 5 |
| allooi | ’n Materiaal wat gemaak word deur ’n metaal met klein hoeveelhede van ander metale of niemetale te vermeng. |
| atoom | Dit is die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. |
| atoomgetal | Die getal protone in die kern van die atoom. |
| atoommassa | Word ook massagetal genoem. Dit is die totale aantal protone en neutrone in die kern van die atoom. |
| buskruit | Ontvlambare mengsel van salpeter, houtskool en swawel. |
| elektrolise | Die proses van losmaak of opbreek met ’n elektriese stroom. |
| elektrone | Baie klein, negatief gelaaide deeltjies (partikels) wat in die energievlakke van ’n atoom rondbeweeg. Elektrone maak die vorming van chemiese verbindings moontlik. 8 |
| element | Dit is ’n stof wat saamgestel is uit atome wat dieselfde atoomgetal het. |
| isotope | Enigeen van twee of meer vorme van ’n element wat dieselfde atoomgetal (protone) en eenderse chemiese eienskappe het, maar waarvan die atoommassa en radioaktiewe gedrag verskil. Die aantal protone en elektrone is dus dieselfde, maar die aantal neutrone verskil. |
| neutrone | Neutrale deeltjies (partikels) wat geen elektriese lading het nie en saam met protone in die kern van die atoom voorkom. ’n Neutron en proton het dieselfde gewig. 8 |
| oksied | ’n Verbinding waarin suurstof met een of meer ander elemente gereageer word. |
| periodieke tabel | Dit is die tabel van die elemente, gerangskik volgens toenemende atoomgetal, sodat elemente met soortgelyke eienskappe in dieselfde vertikale kolom voorkom. |
| potas | Dis ’n mengsel van stowwe wat uit die as van verbrande plante gemaak word wat in water geweek word. Dit staan ook as onsuiwer of natuurlike kaliumkarbonaat bekend. |
| protone | Positief gelaaide deeltjies (partikels) wat in die kern van ’n atoom voorkom en die elektrone in posisie hou. Atome het ewe veel protone as elektrone en het dus ’n neutrale lading. 8 |
| rehidreer | Water of vog te gee sodat die normale balans van water en elektroliete herstel kan word. |
| verbinding | Dit is die samevoeging van ongelyksoortige atome tot molekules. |
Lees hierdie artikels om nog meer te leer oor kalium
Kyk hierdie video’s om nog meer te leer oor kalium
Wat is kalium?
Leer hier meer
Kyk hoe reageer kalium op water!

