Vinnige feite

- Argon kan een neutrale verbinding met fluoor en waterstof vorm. Dit word argonhidrofluoried genoem, maar dit is slegs teen ’n baie koue temperatuur (-256 ℃)
- Groot hoeveelhede argongas word as gevaarlik beskou in toe ruimtes. Dit is digter as lug en kan mense laat verstik.
- Argon het ’n blougroen kleur as dit as ’n gaslaser gebruik word.
- Die simbool vir argon was eens op ’n tyd A, maar daar is in 1957 besluit om dat na Ar te verander.
- Die meeste argon in ons atmosfeer is afkomstig van die radioaktiewe afbreking van kalium.
- Argon-36 word in die heelal gemaak as sterre wat 11 keer groter is as die son, in hul silikonbrandingsfase is. 5
As daar een prentjie is wat Suid-Afrikaners goed ken, is dit donker gloeilampe wat weens beurtkrag nie werk nie … Gloeilampe bevat die element wat in hierdie artikel bespreek word: argon.

Argon is ’n chemiese element wat ’n inerte gas is. Dit beteken dat dit nie op ander elemente reageer nie. Dit is reukloos, smaakloos en kleurloos, maar as elektrisiteit daardeur gelei word, verkleur dit na violet. 1
Argon behoort tot die edelgassegroep op die periodieke tabel. ’n Edelgas is ’n gas wat nie met ander elemente verbindings vorm nie.

Wanneer en deur wie is dit ontdek?
Reeds in 1785 het ’n man genaamd Henry Cavendish besef dat die lug nie net stikstof, suurstof en koolstofdioksied beslaan nie. Hy kon dit egter nie regkry om die ander gasse te isoleer nie.

Sy bevindings was vergete totdat lord Raleigh en sir William Ramsay in 1894, meer as ’n eeu later, met ander gasse begin eksperimenteer het. Hulle het argon, asook ander gasse, ontdek. Argon was die eerste edelgas wat ontdek is. Dit is afgelei van die Griekse woord argos (‘lui’), en dit is juis so genoem omdat die gas nie op ander verbindings reageer nie. 2

Waar kom dit voor?
Argon is die edelgas wat die volopste in die aarde se atmosfeer voorkom. Dit beslaan amper 1% (0,94%) van die lug se volume. Argon word ook in klein hoeveelhede in die aardkors en in die oseaan se water gevind. 1

Waarvoor word dit gebruik?
- Argon word nes neon ook in neonligte en in reklameborde gebruik. Dink net aan al die argon in ’n stad, soos Las Vegas.
- Die gas word ook in elektriese gloeilampe, radiobuise en Geiger-instrumente (wat bestraling kan waarneem) gebruik.
- As gevolg van sy inerte eienskap (die feit dat dit nie op aner elemente reageer nie) word dit dikwels as ’n beskermende gas vir sweiswerk gebruik.
- Argon word ook soms in duikpakke gespuit (amper soos om ’n ballon op te blaas), en dit hou die duikers warm en gemakliker onder die see.
- Argon word dikwels in glaskaste in museums gebruik om historiese dokumente veilig te hou. Dit is omdat argon nie op die chemikalie in die papier of die ink reageer nie en dit help dat die dokument nie verkrummel nie.
- Dit word ook gebruik om chemikalieë, wat met gasse soos suurstof of stikstof in die lug sal reageer, veilig te stoor.
- Soms word argon ook in spuitkannetjies gebruik.
- Vloeibare argon word ook gebruik in chirurgie om kankerweefsel te vernietig.
- Vloeibare argon word ook in laboratoriums vir wetenskaplike eksperimente gebruik.

Basiese eienskappe van argon
- Atoomgetal (getal protone in die kern): 18
- Simbool op die periodieke tabel: Ar
- Relatiewe atoommassa (Ar): 39,948
- Fase van materie teen kamertemperatuur: Gas
- Smeltpunt: -189,35 °C
- Brandpunt: -185,85 °C 3

’n Nota oor atoommassa
’n Massaspektrometer kan gebruik word om atoommassa akkuraat te bereken. Wetenskaplikes het ’n standaardmassa van 12 ame (atoommassa-eenheid) aan die koolstofatoom (koolstof-12) toegeken. Die massa van koolstof-12 is 1,99 x 10-26 kg, en ander atome se massa kan relatief tot hierdie atoommassakonstante bepaal word.
Vandag praat wetenskaplikes van die relatiewe atoommassa (Ar). Hierdie waarde het geen eenheid nie, want dit is slegs ’n syfer wat aandui hoeveel maal groter een atoom van die spesifieke element is as een twaalfde van die massa van ’n koolstof-12-atoom. 4

Atoominligting
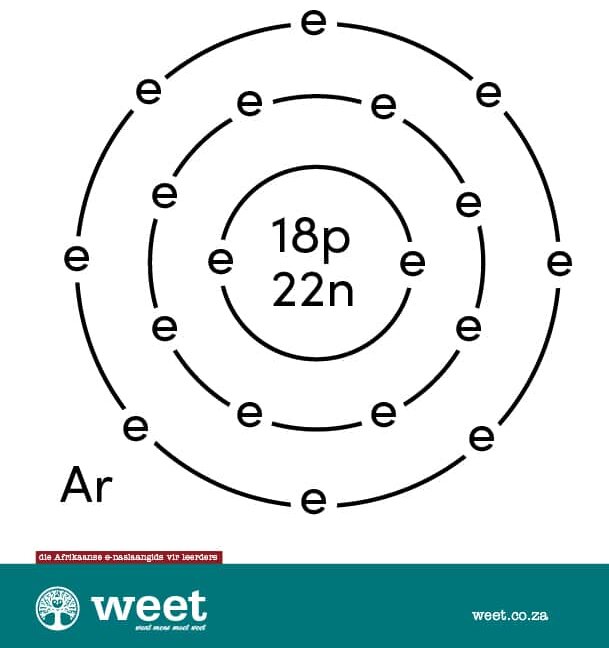
Die Deense wetenskaplike Niels Bohr (1885-1962) het ’n atoommodel voorgestel. Hierdie model word soms die planetêre atoommodel genoem. Die elektrone beweeg in hul spesifieke energievlakke al óm die kern. Deur die aantal energievelde en elektrone te tel, kan die atoom maklik uitgeken word. 4
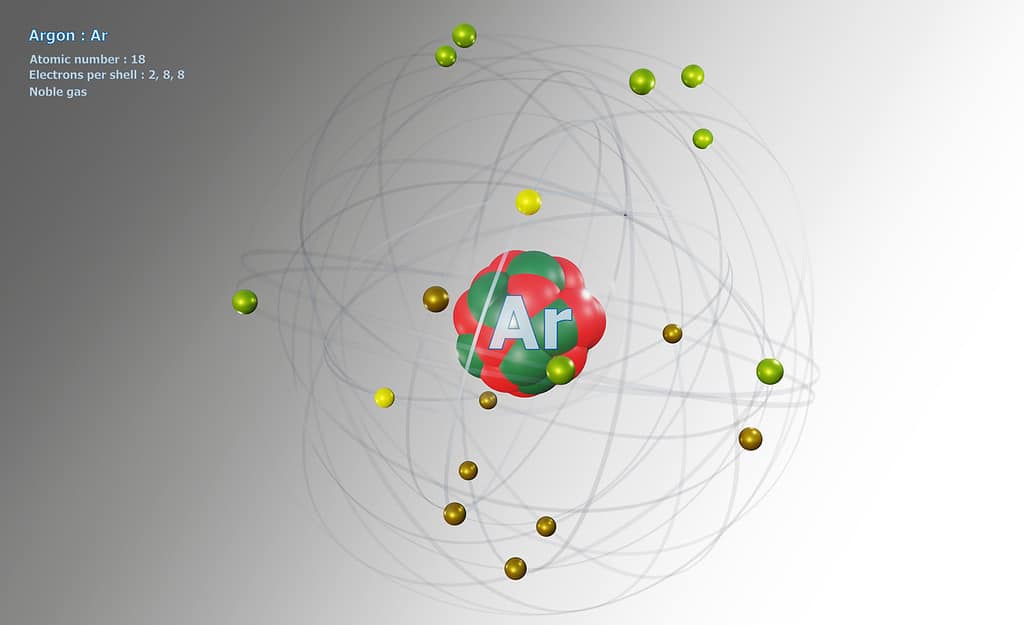
’n Atoom is die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. Atome bestaan weer uit kleiner deeltjies wat subatomiese deeltjies genoem word. Daar is drie soorte subatomiese deeltjies, naamlik elektrone, protone en neutrone. Die argonatoom het ’n atoomgetal van 18. Dit beteken dat die atoom 18 protone het. Atome het ’n neutrale lading, en daarom is daar ook 18 elektrone wat óm die kern beweeg. Die buitenste energievlak het agt elektrone. Dit het ook 22 neutrone wat saam met die protone in die kern voorkom.
Daar is drie stabiele isotope: argon-36, argon-38 en argon-40. Die algemeenste hiervan is argon-36. Die meerderheid argon wat egter natuurlik op aarde voorkom, is argon-40. ’n Isotoop is enigeen van twee of meer vorme van ’n element wat dieselfde atoomgetal en eenderse chemiese eienskappe het, maar waarvan die atoommassa en radioaktiewe gedrag verskil. 1
Argongrappie (al is dit Engels!)
Why don’t I tell chemistry jokes? All the good ones argon!

Woordbank
| atoom | Die kleinste deeltjie van ’n chemiese element wat selfstandig of in verbinding met ander atome kan bestaan. |
| atoomgetal | Die getal protone in die kern van die atoom |
| atoommassa | Word ook massagetal genoem. Dit is die totale aantal protone en neutrone in die kern van die atoom. |
| edelgas | Enigeen van ’n aantal elemente wat in groep 18 gevind kan word. In die natuur vorm die edelgasse nooit verbindings nie, nie eers met hul eie atome nie. Hulle is kleurlose gasse waarvan die atome agt elektrone in die buitenste energievlak het, behalwe helium. |
| elektrone | Baie klein, negatief gelaaide deeltjies (partikels) wat in die energievlakke van ’n atoom rondbeweeg. Elektrone maak die vorming van chemiese verbindings moontlik. 6 |
| element | Dit is ’n stof wat saamgestel is uit atome wat dieselfde atoomgetal het. |
| inerte | Min of geen chemiese werking nie. |
| isotope | Enigeen van twee of meer vorme van ’n element wat dieselfde atoomgetal (protone) en eenderse chemiese eienskappe het, maar waarvan die atoommassa en radioaktiewe gedrag verskil. Die aantal protone en elektrone is dus dieselfde, maar die aantal neutrone verskil. |
| neutrone | Neutrale deeltjies (partikels) wat geen elektriese lading het nie en saam met protone in die kern van die atoom voorkom. ’n Neutron en proton het dieselfde gewig. 6 |
| periodieke tabel | Dit is die tabel van die elemente, gerangskik volgens toenemende atoomgetal, sodat elemente met soortgelyke eienskappe in dieselfde vertikale kolom voorkom. |
| protone | Positief gelaaide deeltjies (partikels) wat in die kern van ’n atoom voorkom en die elektrone in posisie hou. Atome het ewe veel protone as elektrone en het dus ’n neutrale lading. 6 |
| verbindings | Die samevoeging van ongelyksoortige atome tot molekules. 6 |
Lees hierdie artikels om nog meer te leer oor argon
Kyk hierdie video’s om nog meer te leer oor argon en die edelgasse
Leer meer oor argon
Eienskappe en gevare van argon
Wat is die edelgasse? Vind in dié liedjie uit!

